[公開日] 2025年3月25日 [最終更新日] 2025年3月25日
目次
要約:日本における新薬開発
- 日本は世界第3位の医薬品市場
- 全ての薬事承認された医薬品は、日本の国民皆保険制度のもとで保険適用され、原則的に保険償還されます。
- 次世代シーケンス(NGS)による遺伝子検査も保険償還の対象であり、個別化医療の推進に貢献しています。
- 医薬品医療機器総合機構(PMDA)は国際共同治験(グローバル試験)のデータを受け入れる体制を整えており、国際共同での医薬品開発を促進しています。
- 日本で治験を実施することで以下のような複数の利点があります(PoC確立の援助、TRの活性化、アジア展開の加速)
- DLT評価期間中の入院は一律に義務付けられておらず、試験デザインや患者管理の柔軟性が確保されています。
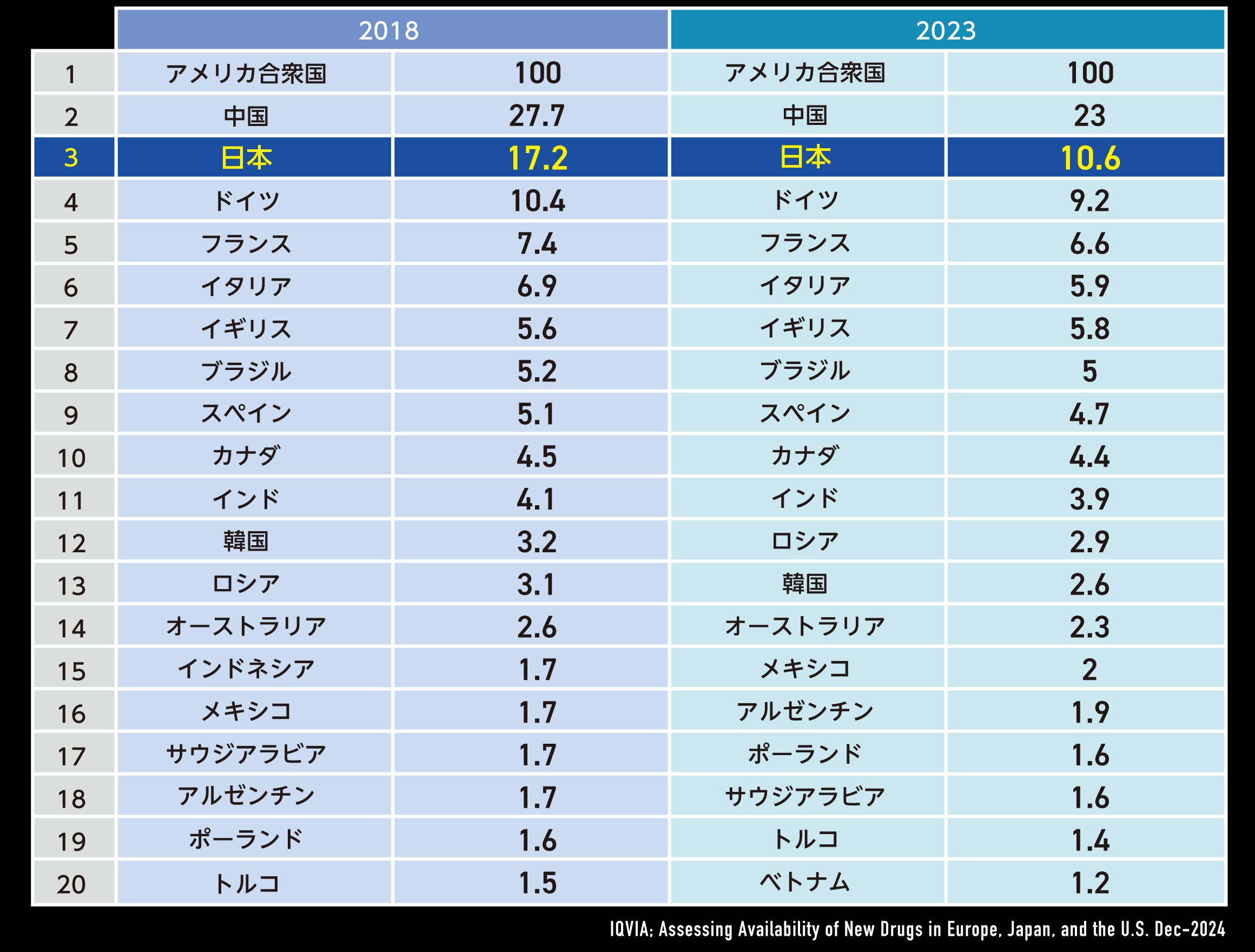
日本は世界第3位の医薬品市場
日本のスナップショット

日本の関与の可能性と実現性
日本の治験参画・実施体制
- PMDAは国際共同治験のデータを受け入れる体制を整えている。
- NCCHは、患者登録に積極的に関与し、日本における臨床試験の実施可能性を向上させている。
日本法人の設立は必須ではない
- ICCCが日本における治験実施・運用を行うため、日本法人の設立は必須ではない。
- ICCCはCTN(治験届)およびIND(治験薬申請)の管理を適切に遂行し規制要件を満たす体制を整えている。
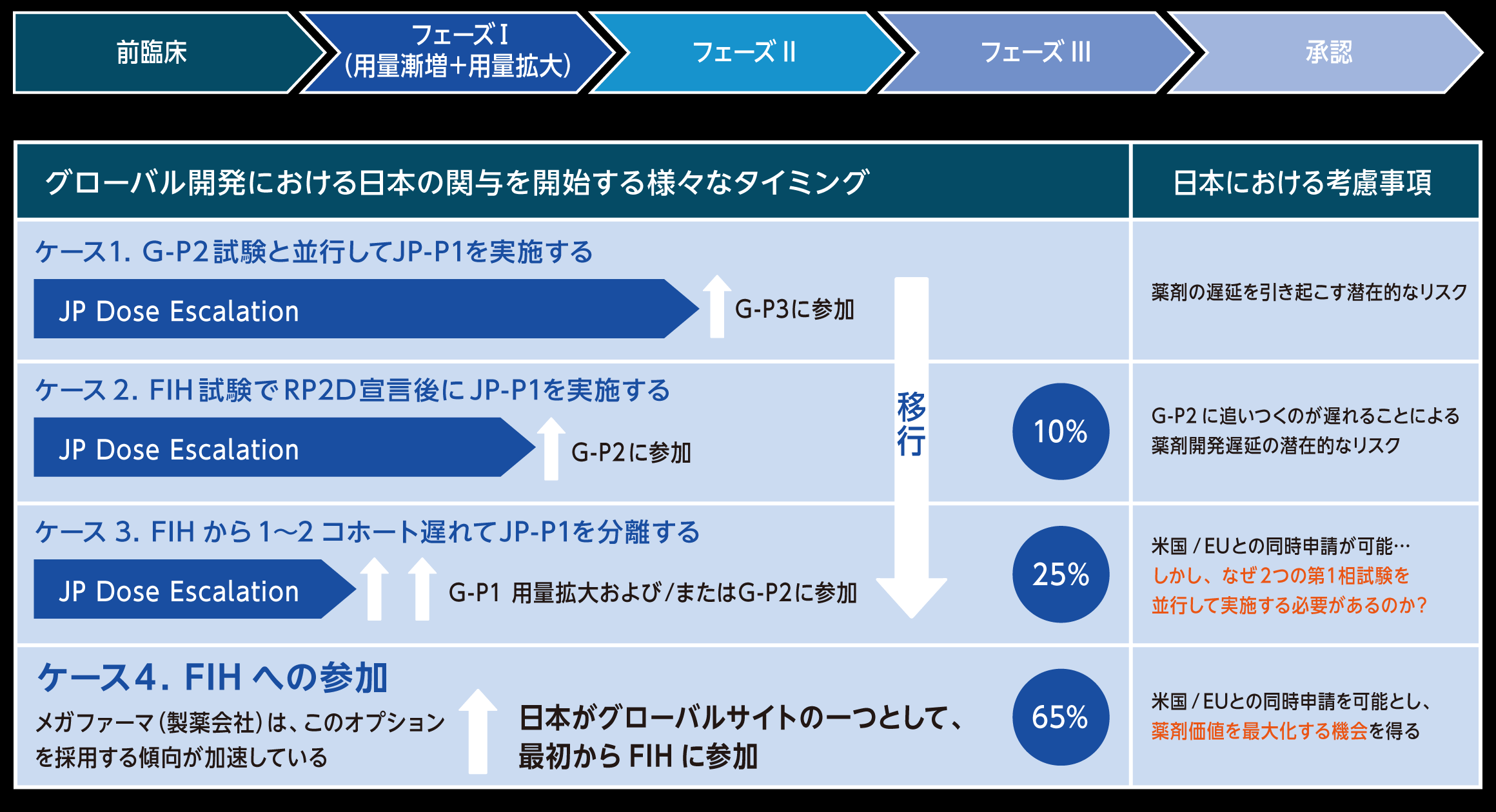
日本における新薬開発の理想的なアプローチ
最も推奨されるアプローチ
- 初期の医薬品開発段階から日本の臨床試験施設を組み込むこと
- 日本でFIH試験及び/又は第Ⅰ相治験を実施することで、アジア人集団(日本人集団)における薬物動態、安全性、忍容性を早期に評価し、アジア圏における治験開発・薬事承認を加速することができる。
次点で推奨されるアプローチ(海外FIH後の対応)
- ピボタル試験に先立ち、少数の日本人患者を対象とした実現可能性試験を実施し、日本人集団における適用可能性および有効性を評価することが可能である。
- 試験のタイムラインに応じて、安全性評価を目的としたSafety run-inコホートの導入も可能であり、早期の安全性評価および最適な用量選択に寄与できる。
日本関与の利点
革新的治療の開発加速
- 日本は手技の質が極めて高く、POC確立のために高精度の腫瘍生検を実施可能である。
- NCCにおけるヒト生体試料(腫瘍組織)や研究所におけるAI研究機関の活用などにより、TR/rTRが円滑に進められる。
- 胃がん、胆管がん、EGFR変異型非小細胞肺がん(NSCLC)などのアジア特有のがん種における重要なバイオマーカーやシグナルを特定することが可能となる。
薬事承認された全ての医薬品が国民保険の適用対象となる
- 医薬品が薬事承認を取得すると、直ちに国民健康保険の適用を受けるため、幅広い患者さんへの提供が可能となり、市場参入の予測性が高い。
新薬開発の機会拡大
- 高精度な腫瘍生検の実施が、正確かつ効率的なPOC評価を可能とし、新薬開発プロセスの最適化が促進される。
- ヒト生体試料(腫瘍組織)の活用がTR/rTRの円滑な実施を可能とする。
- 日本における研究がアジア特有のがん種における重要なバイオマーカーやシグナルを特定することを可能とする。
日本に関与するタイミングのパラダイムシフト